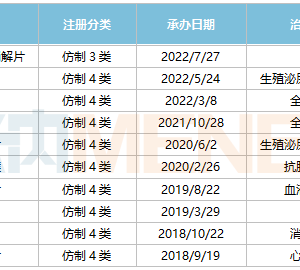
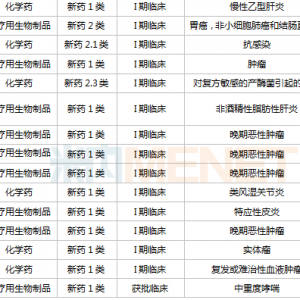
ASCO 2022年会临近,同宜医药自主研发的全球首创双配体偶联药物CBP-1018的I期临床试验入选ASCO口头报告/壁报展示环节。
具体如下:
摘要编号:TPS2694
摘要标题:一项评估双配体偶联药物CBP-1018在晚期实体瘤患者中安全性,耐受性,药代动力学特征和初步疗效的开放标签、非随机、多中心I期研究
AbstractTitle: An open-label, non-randomized, multi-center phase I study evaluating thesafety, tolerability, pharmacokinetics and preliminary efficacy ofbi-ligand-drug conjugate CBP-1018 in patients with advanced solid tumors.
摘要类型:壁报展示/ poster presentation
通讯作者:黄海教授 中山大学孙逸仙纪念医院
第一作者:李锴文副教授 中山大学孙逸仙纪念医院 | 史业辉教授 天津医科大学肿瘤医院
报告人 :李锴文副教授
报告时间:2022年6月5日,8:00 AM -11:00 AM(北美中部夏令时间)
TPS是ASCO摘要中很特别的一类,只介绍进展中临床试验的研究背景和试验方法,不涉及研究结果的数据展示,一般每个瘤种大约只有16篇以内,选为壁报展示的数量更少,入选的均是各领域内的创新药物和具有重要临床价值的研究。作为具有创新机制的双配体偶联药物,CBP-1018的两个配体分别靶向前列腺特异性膜抗原(PSMA)和叶酸受体α(FRα),分别在前列腺癌、卵巢癌等多种实体瘤中高表达。PSMA和FRα靶点的成药性已经得到了验证,以PSMA为靶点的放射配体疗法(RLT)Pluvicto(177Lu-PSMA-617)已在今年3月份获得FDA上市批准,而以FRα为靶点的抗体偶联药物(ADC)IMGN853也在今年4月份已经向FDA递交生物制品上市申请(BLA)。CBP-1018具有双靶点协同作用和小分子配体高穿透性等优势,有望进一步提高疗效,扩大适用人群的范围。
CBP-1018的I期FIH试验设计包括两个部分,Ia期的剂量爬坡阶段和Ib期的剂量扩展阶段。入选的瘤种包括标准治疗失败的转移性去势抵抗前列腺癌,晚期肾细胞癌,晚期肺鳞癌等晚期实体瘤。主要研究终点包括安全性,耐受性,剂量限制性毒性(DLT),最大耐受剂量(MTD),2期推荐剂量(RP2D),以及Ib期剂量扩展阶段的客观缓解率(ORR)。目前项目正在剂量爬坡中。
本网页由机器采集生成,若侵权请及时联系删除。
原文链接:https://med.sina.com/article_detail_100_2_117344.html