文丨药疯
近日,药审中心发布改良型新药临床试验相关通知,对申办方在改良型新药开发方面的疑问进行了非常有价值的解答;且2021年底,笔者曾对改良型新药进行过近3年的注册申报统计分析(详见《新浪医药年度盘点丨2021年化药2类改良型新药迎研发高潮“增速与增数”亮眼》);故,对于本次CDE对申办方所提疑问的解答,有着切实的感受与体会,尤其是CDE对于临床优势的不断强调,笔者感触颇深;特总结此文,以期与行业同仁共成长。
01
改良型新药
最新征求意见稿内容
改良型新药,一直以来都是新药&仿制药研发企业非常希望涉猎却又很难真正投入到其中的一个阵地。从一定角度来说,笔者认为,改良型新药是全学科制药技术的证明,尤其是2.1类、2.2类、2.3类品种。所以,一旦有了实质性的技术突破,往往可以形成一个真正的制药创新技术平台,且呈现的是大量相似品种共性问题的大步突破。基于此,业界一直对改良型新药有着很高的关注度。
国家药监部门为了更好的鼓励申办方在改良型新药方面有所突破,2020年6月CDE发布了“关于公开征求《化学药品改良型新药临床试验技术指导原则(征求意见稿)》意见的通知”,半年后即2020年12月30日,正式发布《化学药品改良型新药临床试验技术指导原则》。而此时,继续发布“关于公开征求《<化学药品改良型新药临床试验技术指导原则>问与答(征求意见稿)》意见的通知”,足见CDE对于改良型新药的重视。
图1.1 CDE发布改良型新药相关征求意见
02
近3年
国内改良型新药的开发统计
笔者曾对改良型新药的注册申报进行过2019-2021连续3年的统计分析,详见《新浪医药年度盘点丨2021年化药2类改良型新药迎研发高潮 “增速与增数”亮眼》,在此,笔者将宏观数据进行摘要,以供读者进行快速了解。
自2019年至2021年近3年的时间里,化药2类改良型新药的注册受理走势整体为上升趋势。总受理号承办数量,自2019年的188条上升到2021年的418条,年增长率近49%;其中,IND承办数量,由2019年的141条上升到2021年的304条,年增长率近47%。在新药&进口分类方面,由2019年的近于持平上升到近于2倍,国内改良新药的受理号承办数量实现了年增长率64%。
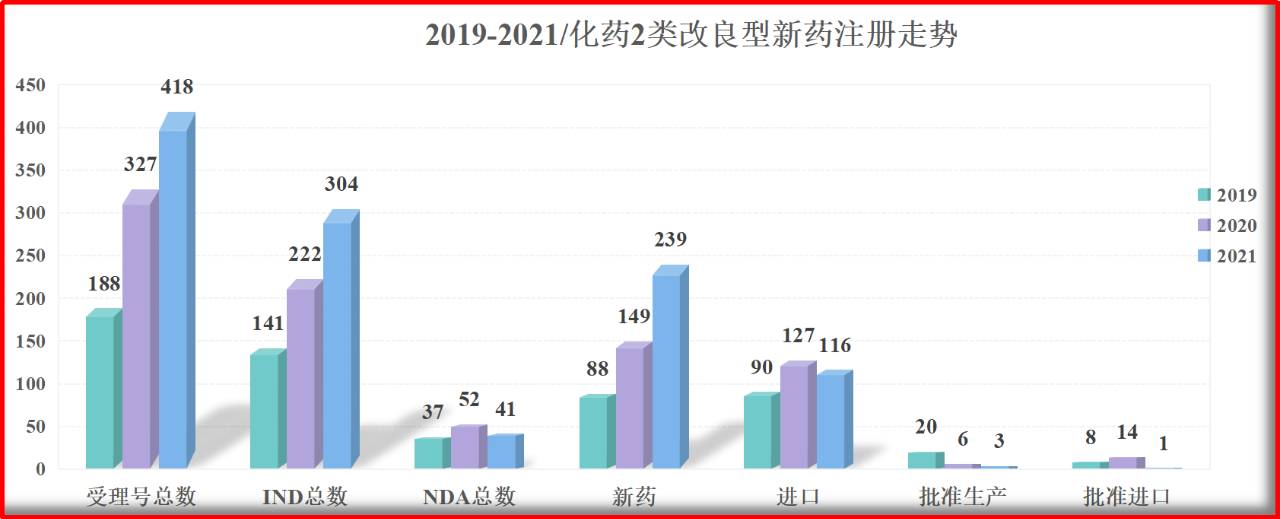
图1.1 2019-2021/化药2类改良型新药注册走势
如上所述,进一步统计2021年2.1/2.2/2.3/2.4类受理号承办数量发现,2.1类和2.3类品种承办数量相对少很多,远不及2.2和2.4。
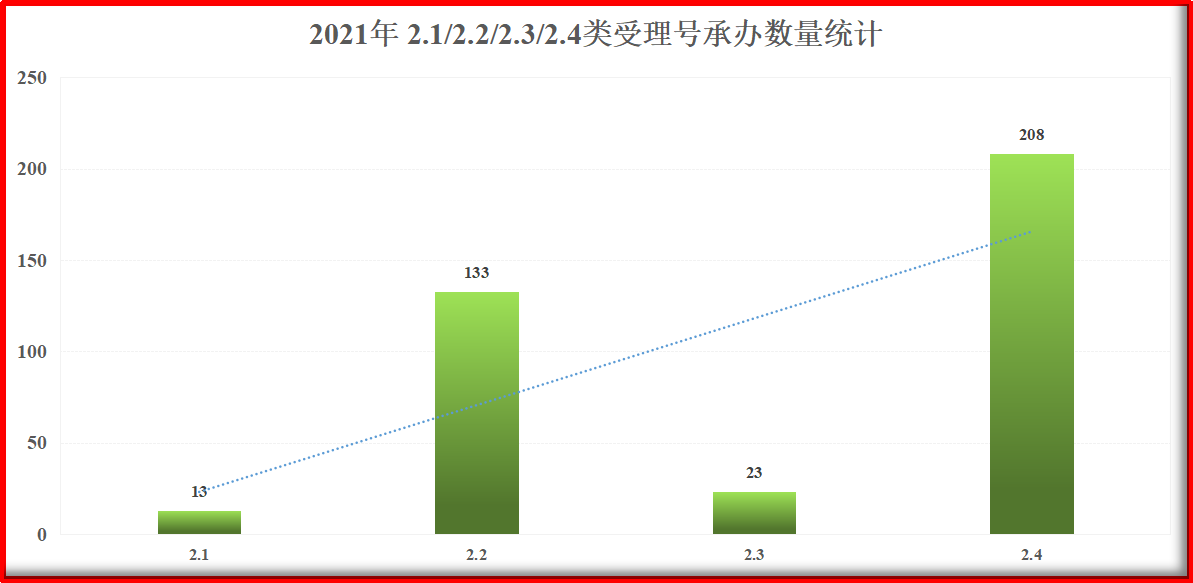
图2.1 2021年2.1/2.2/2.3/2.4类受理号承办数量统计
03
本次征求意见稿
四个方面重点回复
在上述政策发布背景和国内品种注册申报统计背景下,再看本次征求意见稿的具体问答,笔者将从4方面即“有效性”、“新适应症”、“安全性”、“依从性”进行讨论、学习、思考、总结。
NO.1
提高有效性
有效性,主要疑问为:通过优化处方工艺,预期提高有效性,可否通过一个小样本随机对照试验,选用替代重点确证临床优势?
答:认可这种提高有效性方式的立题。
首先应探索剂量-暴露-疗效关系,明确推荐剂量,然后开展与被改良药品的小样本有效性对照试验,如果结果提示有临床优势,建议进一步开展III期临床试验以确证其临床优势。
疗效终点的选择可根据不同适应症的治疗目标确定。例如:紫杉醇聚合物胶束联合铂类用于非小细胞肺癌患者的一线治疗III期研究中,选用被改良药品紫杉醇联合铂类为对照药。
笔者观点:制剂工程的技术提升,可以达到降低药物使用剂量的目的,从而提高有效性,降低毒性。审评老师的回复,在肯定对方立题的同时,还是明确了后续的临床开发计划,还是希望要进一步的在III期阶段明确临床优势。
NO.2
开发新适应症
新适应症,主要疑问为:通过优化处方工艺,拟开发新适应症,是否还需要开展与被改良药品的对照研究?
答:被改良药品未获批该适应症,因此在新适应症研发中应选择目标适应症的标准治疗作为对照确证其临床优势,而无需开展与被改良药品的比对研究。
例如:白蛋白紫杉醇联合吉西他滨开发被改良药品紫杉醇未获批的晚期胰腺癌一线治疗适应症时,关键III期研究中,选用目标适应症的标准治疗吉西他滨为对照药。
笔者观点:CDE再次强调“临床优势”的定义,即与标准治疗作为对照,这一点不仅是改良型新药要注意的,更是所有新药研发的目标和检验标准。申办方一定要不停的理解和实施“临床优势”!
NO.3
改善安全性
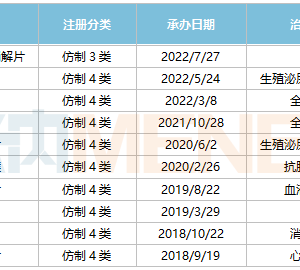
安全性,是本次征求意见稿的讨论重点,这里先进行列表说明,详见下表。
表3.1改善安全性的问与答
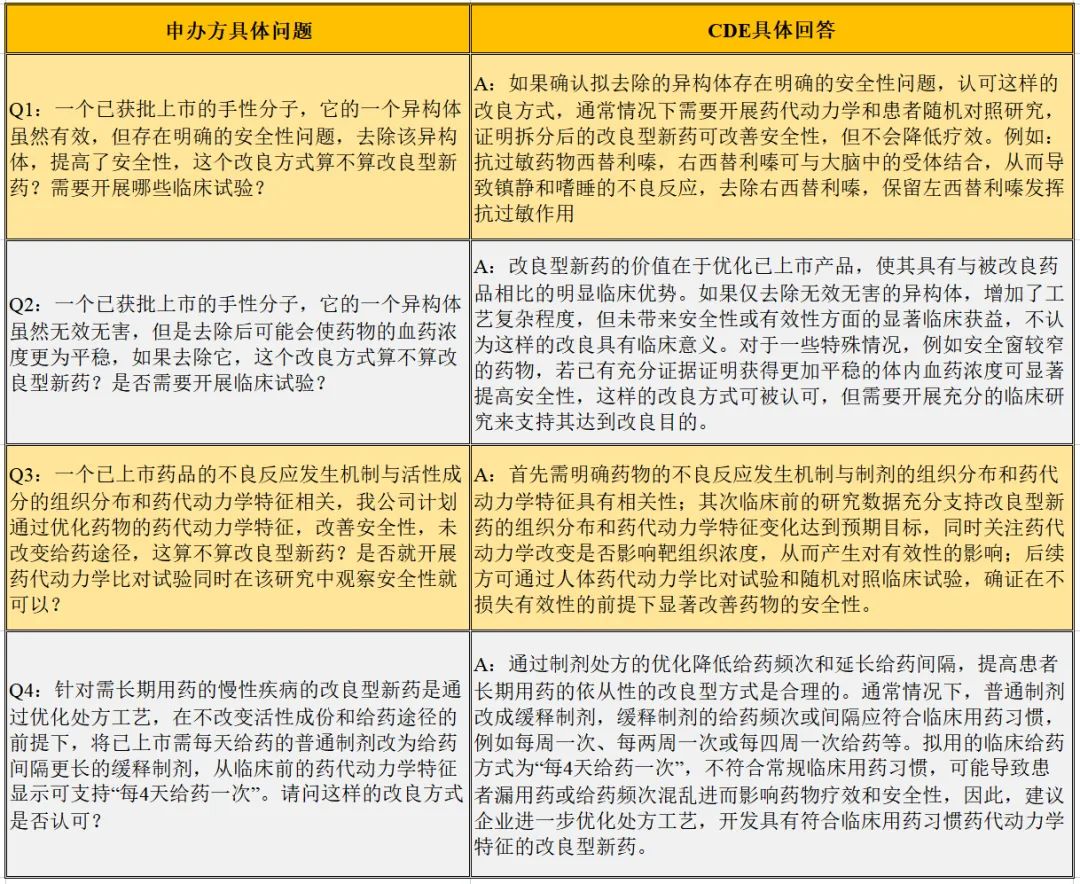
笔者观点:由上述申办方提问不难看出,申办方首先希望确定改良的理念是否可以得到审评中心的认可,其次是希望尽可能的减少临床试验来实现快速开发。基于此,审评中心均对申办方的改良理念进行了“是or否”的明确回复,这一点难能可贵;其次,对开展试验的逻辑给出了具体的操作内容、重点内容,这对于申办方而言,一定程度上明确了项目开发的最低标准,即及格线的具体内容。另,审评中心还是再次不停的强调与解释“临床优势”的实际意义。
NO.4
提高依从性
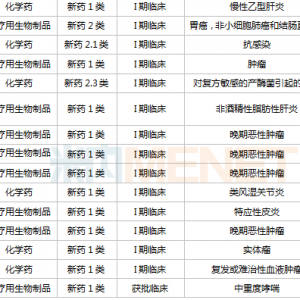
依从性,本次提出了2处疑问,同样进行列表说明。
表3.2提高依从性的问与答
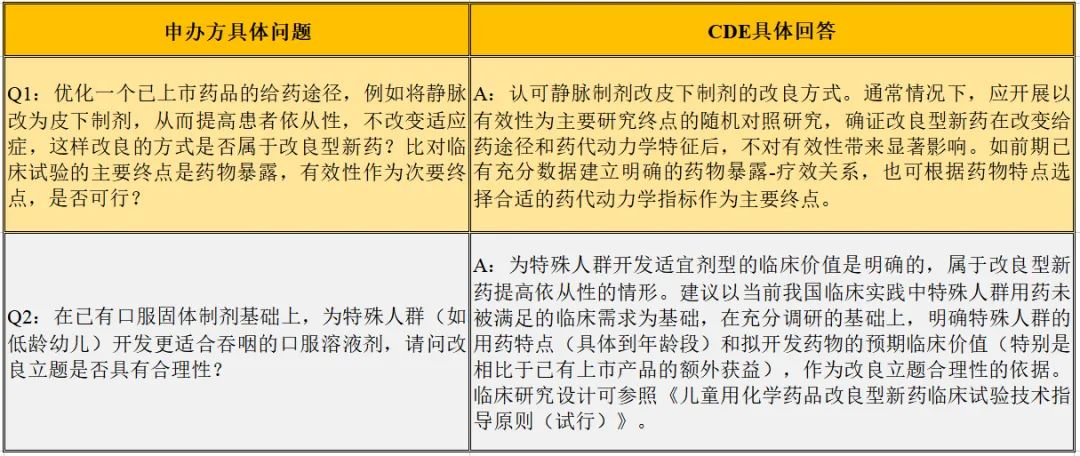
笔者观点:申办方提高依从性的两个问题,得到了审评中心老师的认可,尤其是特殊人群方向,可以看出中心老师的鼓励。而对于临床主要终点和次要终点的设置,可以看出申办方与中心老师的侧重点有所不同,且中心老师在对该问题进行指导的过程中,给出了全面的回答。
04
小结&小论
综上,即为笔者针对本次“问与答”的一些心得体会,进一步概括总结有以下几点:
1)我国药企对改良型新药的研发热度在逐年升高,国内制药技术发展很快;
2)药审中心针对改良型新药于近些年关注度提升,并对该方向的发展起到了积极作用;
3)申办方提出的问题主要为“立题是否成立”和“临床方案是否可行”两方面;中心老师给出的回复,首先给出明确答复“是与否”,其次对临床试验的开展内容给出了明确的指导,对真正希望在改良型新药方向有所投入的申办方来说,非常有帮助;
4)审评老师回答问题的核心,还是在“临床价值”上,所以申办方如何将药物进行改良并最终实现了真正的临床优势,才是项目开发的最初目标和最终结果。
以上,均为笔者在自身经验的基础上所产生的一些想法,笔者深知新药研发的“难”与“度”,更深知自身的才疏学浅,不对之处,还请同行指正。
参考资料:
1.https://www.cde.org.cn/main/news/viewInfoCommon/00ceb9c111e31a5a8d168dc3e1da242d
2.新浪医药年度盘点丨2021年化药2类改良型新药迎研发高潮“增速与增数”亮眼
*声明:本文由入驻新浪医药新闻作者撰写,观点仅代表作者本人,不代表新浪医药新闻立场。
本网页由机器采集生成,若侵权请及时联系删除。
原文链接:https://med.sina.com/article_detail_103_2_114450.html