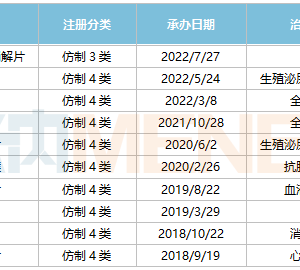
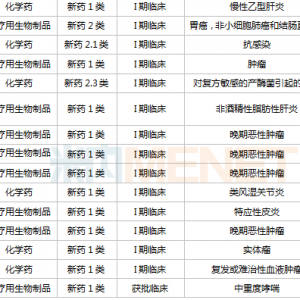
一、前言
Ⅰ型糖尿病患者依赖于每日多次注射或持续皮下输液泵提供的外胰岛素治疗,以控制葡萄糖水平升高,并防止危及生命的酮症酸中毒的发展。由于皮下胰岛素提供的药动学和药效学限制,大多数生活在Ⅰ型糖尿病的患者无法达到预防Ⅰ型糖尿病并发症的葡萄糖控制水平。
因此,长期以来β细胞替代提供的生物胰岛素治疗一直被希望取代外源性胰岛素治疗Ⅰ型糖尿病,但只有在胰腺或孤立胰岛移植的有限背景下才能实现,而且需要使用已故的供体器官。最近在从人类干细胞来源产生功能性胰岛β细胞方面的进展,重振了一天无限供应胰岛用于移植治疗的希望。
虽然该方法能够逆转链脲佐菌素诱导的小鼠免疫模型中的糖尿病,但胰腺内胚层细胞的使用一直伴随着中胚层细胞的零星生长,使人担忧畸胎瘤的形成。胰岛阶段细胞的使用有望最大限度地减少非靶向分化;然而,这些后期内分泌细胞仍在体内进一步分化,因此可能无法完全消除与移植未成熟干细胞-衍生组织相关的潜在风险。
二、方法
Pepper等人利用皮下“无装置”的部位,为链脲佐菌素诱导的糖尿病小鼠模型移植的人胚胎干细胞衍生胰腺内胚层细胞,提供长期的胰岛细胞功能和组织学特征。
三、结果
所有胰腺内胚层细胞受体小鼠在200天内建立正常血糖,与胰岛移植物的体内分化和功能成熟一致,并维持500天以上,直到移植物去除。在功能上,成熟的移植物显示葡萄糖反应的胰岛素分泌,这可以在体内通过测量人C肽和体外通过测量胰岛素分泌得到证实。
在组织学上,胰腺内胚层细胞分化为大多数胰岛组织;然而,所有胰腺内胚层细胞受体移植物也在200天内出现可触及的小囊肿,构成化生性胰管粘膜增生。但在超过500天的观察中没有改变,支持了这些病变的良性分类。
胰腺内胚层细胞移植物没有显示畸胎瘤形成的证据,表明中胚层分化的风险可能被消除。移植前进一步体外分化为胰岛阶段组织是否可能消除不必要的导管囊肿的发展,需要额外的长期研究。
四、讨论
葡萄糖稳态的长期功能调节是通过移植胰腺内胚层细胞移植在皮下“无装置”的部位来实现的,该部位易于监测,包括活检和检索。这里报道的无器件位点可能是移植干细胞的一种有吸引力的替代方案-衍生胰岛。
除了β细胞外,人类胰岛还含有产生胰高血糖素的α细胞和较小比例的产生生长激素的δ细胞、产生胃泌素的ε细胞和产生胰腺多肽的F细胞(PP-细胞),以及包括调节胰岛活动和激素分泌的交感神经和副交感神经系统的神经血管元素。胰腺内胚层细胞移植物表现出对β-、α-、δ-、ε-和PP细胞的内分泌分化,类似于成熟的人胰岛的组成。
在人类Ⅰ型糖尿病中,来自天然胰岛内的功能β细胞的丢失破坏了一个细胞功能的旁分泌调节。因此,在低血糖的发展过程中,α细胞不能释放胰高血糖素,这是增加肝脏葡萄糖产生和纠正低血糖所必需的。因此,治疗Ⅰ型糖尿病的细胞疗法除了β细胞外,还需要功能正常的α细胞。
为此,重要的是,这里描述的分化的胰腺内胚层细胞移植物同时含有β细胞和α细胞,就像干细胞在移植前在体外进一步分化为胰岛一样。仍然需要更完整的评估成熟的胰腺内胚层细胞和其他干细胞诱导产生胰岛移植β细胞的胰岛素分泌关闭功能,α细胞适当地打开胰高血糖素分泌,以防御低血糖的发展。
到目前为止,肝脏是唯一使移植胰岛能够持续逆转糖尿病并在大型动物模型和人类中实现胰岛素独立的部位。这可以解释为广泛的生物支架的表面积,由肝窦提供支持肝内植入,门静脉提供有限的,但关键的氧合,直到胰岛重新血管化的肝动脉系统。
在Ⅰ型糖尿病患者中移植时,肝内胰岛重新建立胰岛素分泌,使葡萄糖调节正常化。在糖尿病中,皮下无装置部位是否可以为治疗细胞治疗提供胰岛素生理功能,需要考虑作为临床前开发干细胞的一部分,用于治疗糖尿病的衍生胰岛。
【声明】本文仅供学习交流。
本网页由机器采集生成,若侵权请及时联系删除。
原文链接:https://med.sina.com/article_detail_103_2_109179.html